Info für Zuweiser - neuroendokrine pankreastumore
Hauptmenü:
Info für Zuweiser
Geschichtliche Entwicklung
Mit der Entdeckung und Anwendung des Insulins von Banting und Best 1922 zur Behandlung des Diabetes mellitus wurde auch bei Nicht-
In den folgenden Jahren wurden neuroendokrine Pankreastumore (pNENSs) lediglich als Insulinome bzw. Beta-
"We feel that a new clinical syndrome can be supported, and we hope you will review your problem cases of peptic ulcer to determine if it is a definite syndrome and, if so, how frequently it occurs." Diesen Wunsch äußerte Dr. Robert Zollinger vor 50 Jahren während der initialen Präsentation des Zollinger-
In den 60er und 70er Jahren kam es dann nach der Entdeckung weiterer Hormone und dementsprechenden radioimmunologischen Nachweismethoden im Labor, zur Definition einer Reihe weiterer Tumorsyndromen. Als Beispiel dient das Verner-
Zu erwähnen sind zudem die nichtfunktionellen neuroendokrinen Tumoren des Pankreas (NFPT). Sie rufen klinisch kein hormonelles Syndrom hervor, da sie entweder zu geringe Mengen an funktionell aktiven Hormonen, inaktive Vorstufen oder aber Hormone, die beim Menschen zu keinem typischen klinischen Krankheitsbild führen (z. B. pankreatisches Polypeptid), produzieren.
Nomenklatur und Klassifikation von pNENSs
Es besteht eine verwirrende Vielzahl von alternativ verwendeten Bezeichnungen für die hier diskutierten Tumore. Die Termini Karzinoid, endokriner Tumor, neuroendokriner Tumor, neuroendokrines Karzinom, APUDom, gastroenteropankreatischer Tumor und Inselzelltumor sind im Umlauf und werden leider auch heute noch immer benutzt. Von einer Gruppe international angesehener Pathologen wurde der Begriff "neuroendokriner Tumor" bzw. bei Vorliegen einer Metastasierung der Begriff "neuroendokrines Karzinom" vorgeschlagen, wobei die endokrinen Pankreastumoren auch als Inselzelltumoren bezeichnet werden. Allgemein sollte aber dem Terminus "neuroendokriner Pankreastumor" der Vorzug gegeben werden. Tumoren, die mit einem hormonellen Syndrom vergesellschaftet sind, welches die übermäßige Produktion des jeweiligen Hormons verursacht, werden als Gastrinom (Zollinger-
Die neue WHO-
Epidemiologie
Die Häufigkeit der kleinen (<1 cm), asymptomatischen pNENSs beläuft sich auf 0,4-
Molekulare Grundlagen
Während die molekularen Grundlagen der familiären pNENSs (neben dem MEN1 auch das von-
Im Gegensatz zu anderen Tumoren, insbesondere auch dem duktalen Adenokarzinoms des Pankreas, spielen die Aktivierung von Onkogenen wie K-
Klinisches Erscheinungsbild
Insulinom
Die Whipple-
Gastrinom
Eine Ulkuserkrankung liegt in über 90% der ZES-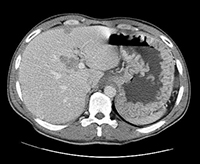 Dabei zeigte sich, dass Bauchschmerzen bei 75% und Diarrhö bei 73% der Patienten auftraten. Sodbrennen, Übelkeit, Erbrechen und Gewichtsverlust traten in 42%, 28%, 26% bzw. 17% der Fälle auf. Gastrointestinale Blutungen waren in einem Viertel der Patienten das initiale Symptom. Wie schwer die Diagnosestellung des ZES auch heute noch fällt zeigt, dass nur bei 3% der 261 Patienten initial die richtige Diagnose gestellt wurde. Die häufigsten Fehldiagnosen waren die idiopathische Ulkuskrankheit (71%), idiopathische Refluxkrankheit (7%) und chronische Diarrhöe (7%).
Dabei zeigte sich, dass Bauchschmerzen bei 75% und Diarrhö bei 73% der Patienten auftraten. Sodbrennen, Übelkeit, Erbrechen und Gewichtsverlust traten in 42%, 28%, 26% bzw. 17% der Fälle auf. Gastrointestinale Blutungen waren in einem Viertel der Patienten das initiale Symptom. Wie schwer die Diagnosestellung des ZES auch heute noch fällt zeigt, dass nur bei 3% der 261 Patienten initial die richtige Diagnose gestellt wurde. Die häufigsten Fehldiagnosen waren die idiopathische Ulkuskrankheit (71%), idiopathische Refluxkrankheit (7%) und chronische Diarrhöe (7%).
Enorme Magenwandhypertrophie bei Patienten mit Zollinger-
NFPT
NFPT führen zu keinem spezifischen klinischen Syndrom. Die Diagnose der NFPT wird daher häufig erst relativ spät gestellt, da lediglich durch ihre Tumormasse Symptome hervorgerufen werden, vergleichbar denen exokriner Pankreastumoren. Die häufigsten Symptome bei Patienten mit sporadischen NFPT sind unspezifische abdominelle Beschwerden (Übelkeit, Erbrechen und Diarrhöe), Ikterus, Gewichtsverlust bzw. eine palpable Tumormasse im Abdomen. Die Tumorlokalisation ist maßgeblich verantwortlich für die Art der auftretenden Symptome. NFPTs im Pankreaskopf führen häufig durch Obstruktion des intrapankreatisch verlaufenden Gallenganges zu einem Ikterus oder durch Irritation intrapankreatischer Nerven zu Rückenschmerzen, während sich Tumoren linksseitig der angesprochenen Gefäße eher durch unspezifische Oberbauchschmerzen bzw. als palpable Masse bemerkbar machen, oft aber sehr lange asymptomatisch bleiben.
MEN1-
Spezielle Informationen zu den MEN1-
Eine Zusammenfassung der klinischen Erscheinungsbilder der pNENSs ist in Tabelle 1 dargestellt.
Tabelle 1. Klinische Erscheinungsbilder der neuroendokrinen Neoplasien des Pankreas
Tumor (Syndrom) |
Inzidenz aller pNENSs |
Klinik |
Malignität |
Insulinom |
70- |
Schwäche, Schwitzen, Tremor, Tachykardie, Angst, Müdigkeit, Kopfschmerzen, Übelkeit, Anfälle und Bewußtlosigkeit |
<10% |
Gastrinom (ZES) |
20- |
Kaum zu behandelbare, rezidivierende gastrointestinale Ulzera, Übelkeit, Erbrechen, Diarrhö |
50- |
Nicht- |
30%- |
Verschlussikterus, Pankreatitis, Oberbauchschmerzen, Duodenalobstruktion, Gwichtsverlust, Müdigkeit |
60- |
VIPom (WDHA) |
4% |
Sekretorische, wässrige Diarrhö, Hypokaliämie, Hypotension, Azidose |
80% |
Glukagonom |
4% |
Gewichtsverlust, Kachexie, Nekrolytisches migratorisches Exanthem, Diabetes mellitus, Glossitis, Stomatitis, Diarrhö |
80% |
Somatostatinom |
<5% |
Gewichtsverlust, Cholezystolithiasis, Diarrhö, Steatorrhö, Neurofibromatose Typ I |
50% |
Karzinoid (Serotoninproduzierend) |
<1% |
Flush, Schwitzen, Diarrhö, Ödeme |
90% |
ACTHom oder CRFom |
<1% |
Cushing Syndrom |
>90% |
GRFom |
<1% |
Akromegalie |
30% |
PTH- |
<1% |
Hyperkalzämie, Knochenschmerzen |
>90% |
ZES: Zollinger-
Biochemische Sicherung und bildgebende Diagnostik
Biochemische Sicherung
Insulinom
Bei Verdacht auf das Vorliegen eines Insulinoms stellt die parallele Bestimmung von Insulin, Blutglukose und C-
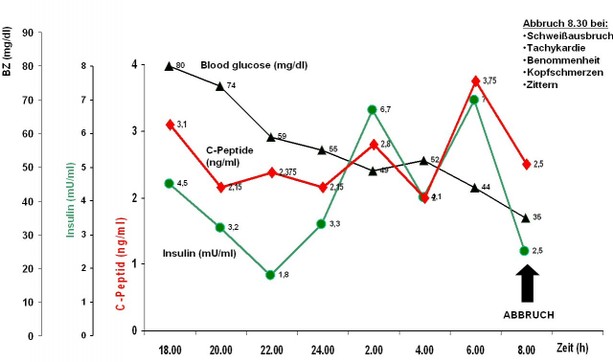
Typischer Verlauf eines Hungerversuches mit kontinuierlichem Abfall des Blutzuckers und anhaltend hohen Insulin-
Gastrinom
Das Serumgastrin ist bei 98% der ZES-
NFPT
NFPT können eine ganze Vielzahl von Hormonen, Proteinen und Glykoproteinen produzieren, vor allem Pankreatisches Polypeptid (PP), Chromogranin A (CgA), Neuronen-
MEN1
Spezielle Informationen zu den MEN1-
Bildgebende Diagnostik
Insulinom
Die Sensitivität hängt von der Lokalisation des Tumors und der Fertigkeit des Untersuchers ab. Im Pankreaskopf wird sie bis zu 100 %, im Pankreaskorpus mit 78 % und im Pankreasschwanz mit 60 % angegeben. Die Nachweisgrenze der Insulinome liegt bei einem Tumordurchmesser von 2-
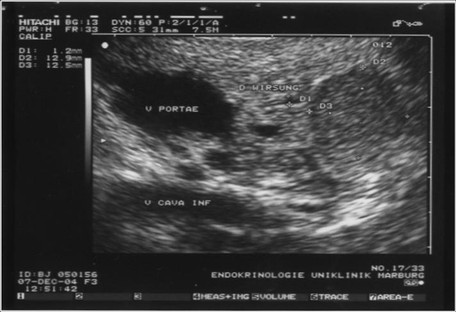 Durch die Anwendung der multiphasischen Dünnschicht-
Durch die Anwendung der multiphasischen Dünnschicht-
Endosonographie des Pankreas mit typischem echoarmen Befund eines Insulinoms.
Nach biochemischer Sicherung eines organischen Hyperinsulinismus durch einen Hungerversuch und Ausschluss eines metastasierten Insulinoms durch transabdominellen Ultraschall oder CT, sollte keine weitere präoperative Lokalisationsdiagnostik durchgeführt werden. Wie bereits erwähnt können durch intraoperativen Ultraschall und bidigitaler Palpation der gesamten Drüse nahezu alle Insulinome identifiziert werden. Eine Ausnahme besteht bei einer laparoskopisch geplanten Operation. Dort sollte präoperativ zusätzlich eine Endosonographie durchgeführt werden, um die intrapankreatische Lage des Tumors und seine Beziehung zum Ductus pancreaticus festzulegen. Zudem kann bei der laparoskopischen Technik keinesfalls auf die intraoperative, hier dann laparoskopische Sonographie verzichtet werden. Nur so lässt sich der Verlust der Palpation bei der laparoskopischen Operation kompensieren.
Gastrinom
Zwischen 80 und 90 % aller Gastrinome sind im so genannten Gastrinom-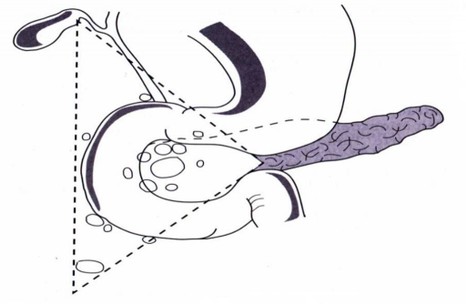 Die Größe der Tumoren variiert mit ihrer Lage: Pankreatische Gastrinome messen 1-
Die Größe der Tumoren variiert mit ihrer Lage: Pankreatische Gastrinome messen 1-
Gastrinomdreieck
Computertomographie 39%, Kernspintomographie 46% und selektive Angiographie 48%. Dagegen ermöglicht die Endosonographie selbst kleinste Tumoren zu entdecken und hat sich als das sensitivste Verfahren zur Entdeckung von pankreatischen Gastrinomen etabliert.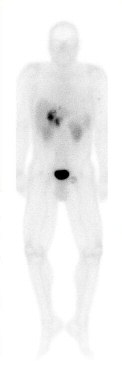
Zimmer und Mitarbeiter konnten bei 15 Patienten mit ZES in 79% den pankreatischen Tumor korrekt lokalisieren. Anderson et al. wiesen alle 36 pankreatischen Gastrinome bei ihren Patienten nach. Allerdings ist auch die Endosonographie fast nie in der Lage, Duodenalwandgastrinome zu identifizieren. Auch die SRS soll eine hohe Sensitivität von über 90% besitzen, wobei hier in der Literatur meist keine Differenzierung zwischen Primärtumor und Metastasen gemacht wird. Die Untersuchung eignet sich gut zum Staging der Erkrankung, jedoch nur ausnahmsweise zur Lokalisation von Primärtumoren. Ähnlich dem Vorgehen beim Insulinom ist auch beim sporadischen Gastrinom die subtile chirurgische Exploration des Pankreas mit Palpation der Drüse und intraoperativem Ultraschall (IOUS), sowie die Duodenotomie die Methode der Wahl um ein Gastrinom zu lokalisieren. Die Sensitivitätsraten für Palpation und IOUS liegen bei 91% bzw. 95%.
Somatostatin-
NFPT
NFPT sind bei Diagnosestellung meist ? 5cm im Durchmesser. Dadurch ist die präoperative Lokalisation erheblich erleichtert und gelingt und im Gegensatz zu den oft sehr kleinen Insulinomen und Gastrinomen in den allermeisten Fällen.CT, MRT und US erzielen jeweils Detektionsraten von > 90%.
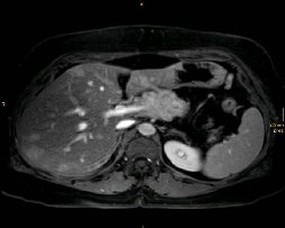 Die hochauflösende, multiphasische Spiral-
Die hochauflösende, multiphasische Spiral-
Auf Grund der erwähnten einfachen Diagnosestellung der NFPT durch CT und US spielt die Endosonographie (EUS), bei weitem nicht die bedeutende Rolle, die ihr bei der Lokalisation der kleineren funktionellen endokrinen Pankreastumore gewiss. Die SRS hat bei NFPT eine Sensitivitätsrate von 80-
Limitierend ist, dass durch die SRS oft keine Aussage über die exakte anatomische Lokalisation getroffen werden kann. Dennoch ist die SRS nicht nur zur Abgrenzung gegenüber exokrinen Pankreastumoren die wesentliche Untersuchung, sondern auch allen anderen Untersuchungen im Staging der Erkrankung überlegen.
Prognose
Unter den Pankreastumoren haben die pNENSs aufgrund eines häufig langsamen Wachstums eine vergleichsweise günstige Prognose. Genau so heterogen wie die klinische Symptomatik der Tumore ist jedoch auch ihre Prognose. Kleine, benigne Insulinome werden durch eine einfache Enukleation entfernt. Die Patienten sind damit in der Regel geheilt. Gastrinome und NFPTs dagegen metastasieren in 50-
Operative Therapie
Operationsindikation beim Insulinom
Entscheidend für die Indikationsstellung zur Operartion ist ein akkurat durchgeführter und dokumentierter Hungerversuch mit biochemischem Nachweis des organischen Hyperinsulinismus und sicherem Ausschluss einer faktiziellen Hypoglykämie, induziert durch Insulingabe oder Einnahme von oralen Antidiabetika. Nach biochemischer Sicherung des Insulinoms ist die Operationsindikation immer gegeben
Operatives Vorgehen beim sporadischen Insulinom
Die einzig kurative Behandlungsmethode eines Insulinoms ist die komplette operative Entfernung. Hierdurch werden die Symptome der Neuroglukopenie und auch der hyperadrenergen Reaktion dauerhaft beseitigt. Benigne Insulinome sollten parenchymsparend und möglichst lokal entfernt werden. Dies gelingt in erfahrener Hand in über 95% durch den Ersteingriff. Wesentlich sind eine gute Vorbereitung des Patienten und die Operation in erfahrener Hand, am besten in einem entsprechenden Zentrum. Nach Eröffnung des Abdomens erfolgt ein ausgedehntes Kocher-Anschließend erfolgt auch bei bereits identifiziertem Tumor eine IOUS, deren Nutzen in zahlreichen Studien belegt ist. Angestrebtes Verfahren beim benignen Insulinom ist die parenchymsparende Enukleation. Bei oberflächlicher Lage gelingt dies in der Regel gut, da die Tumoren meist eine Pseudokapsel haben, wodurch sich eine klare Dissektionsebene zwischen Tumor und normalem Pankreas etablieren lässt. Liegt der Tumor tief im Parenchym oder in unmittelbarer Nähe zum Pankreasgang, ist ein Resektionsverfahren entsprechend der Lokalisation vorzuziehen.
Enukleation eines benignen Insulinoms.
Dies bedeutet in der Mehrzahl der Fälle eine milzerhaltende Pankreaslinksresektion. In sehr seltenen Fällen kann bei großen Tumoren oder tiefer Lokalisation im Pankreaskopf auch eine pylorus-
Operationsindikation beim sporadischen Gastrinom
Nicht nur zur Zeit der Erstbeschreibung 1955, sondern auch noch Mitte der siebziger Jahre lautete das von Robert Zollinger vorgeschlagene Erfolgsrezept zur Behandlung des ZES: "Removal of either all of the tumor or all of the acid surface." Eine operative Behandlung von sporadischen Gastrinomen ist immer angezeigt, auch bei negativem Nachweis der bildgebenden Verfahren, wenn keine diffusen Lebermetastasen vorliegen. In einer Studie an fast 200 Patienten mit Gastrinomen konnte gezeigt werden, dass nach einer Nachbeobachtungszeit von 12 Jahren 41% der operierten Patienten dauerhaft geheilt waren. Zudem entwickelten 29% der konservativ behandelten Patienten Lebermetastasen, während dies bei nur 5% der primär operierten Patienten zu beobachten war (P< 0,001).
Operatives Vorgehen beim sporadischen Gastrinom
Standardvorgehen beim sporadischen Gastrinom ist die komplette Freilegung des Pankreas mit bidigitaler Palpation und intraoperativer Sonographie (IOUS). Zu berücksichtigen ist hierbei, dass sich mehr als 90% der Gastrinome im sog. Gastrinomdreieck (resultierend aus Verbindungslinien zwischen Pankreaskopf, Pars descendens duodeni und Lig. hepatoduodenale) befinden. Standardtherapie ist die Duodenotomie und Resektion von Duodenalwandgastrinomen sowie die Enukleation von pankreatischen Gastrinomen im Kopf oder die Linksresektion bei Tumoren im Korpus-
Kleines sporadisches Duodenalwandgastrinom nach Duodenotomie.
Glukagonome, VIPome und Somatostatinome
VIPome, Glukagonome und Somatostatinome sollten ebenfalls einem aggressiven chirurgischen Vorgehen unterzogen werden, wenn dies nach einem entsprechenden Staging möglich erscheint. Aufgrund der sehr kleinen vorliegenden Fallzahlen und fehlender Langzeitnachbeobachtungsdaten ist die optimale Behandlung der Somatostatinome bis heute nicht definiert. Bei Patienten mit Lebermetastasen sollte ein Tumordebulking zur Senkung der Hormonkonzentrationen im Serum und der damit verbundenen klinischen Symptomen in Erwägung gezogen werden. Aufgrund des Fehlens entsprechender Daten, kann nur aus Einzelberichten von einer verbesserten Prognose für den Patienten geschlossen werden.
Im Gegensatz zu Gastrinomen und benignen Insulinomen sind diese Tumoren meistens groß (mehrere Zentimeter im Durchmesser) und können in allen Abschnitten der Drüse liegen. Zu einer adäquaten Behandlung sind formale Pankreasresektionen notwendig, ebenso wie Leberresektionen bei Metastasen, wenn dies denn möglich ist. In Ausnahmefällen können diese Tumoren bzw. ihre Lebermetastasen durch Resektion des Primärtumors und Lebertransplantation oder auch durch Exenteration und Clustertransplantation behandelt werden. Diese Therapieoptionen sind jedoch als experimentell anzusehen und die mittelfristigen Ergebnisse sind relativ ernüchternd, wobei es sich um Eingriffe mit hoher Morbidität und Mortalität handelt.
NFPTs
Operationsindikation
Die chirurgische Therapie spielt unter den Optionen bei NFPT die entscheidende Rolle. Das Hauptziel ist die potentiell kurative R0-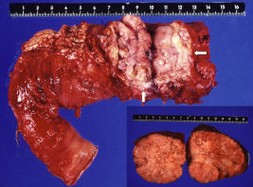 Im Gegensatz zum duktalen Adenokarzinom des Pankreas, an dem mindestens 80% im ersten Jahr nach Diagnosestellung versterben, sind NFPT sehr langsam wachsende Tumoren. Viele Patienten überleben 5 Jahre und länger, selbst wenn Metastasen vorliegen. Daher ist die Indikation zur Operation bei Patienten mit NFPT ohne diffuse Fernmetastasierung immer gegeben. Dies schließt auch benigne, kleine NFPT ein, da diese ein signifikantes Potential zur malignen Entartung haben.
Im Gegensatz zum duktalen Adenokarzinom des Pankreas, an dem mindestens 80% im ersten Jahr nach Diagnosestellung versterben, sind NFPT sehr langsam wachsende Tumoren. Viele Patienten überleben 5 Jahre und länger, selbst wenn Metastasen vorliegen. Daher ist die Indikation zur Operation bei Patienten mit NFPT ohne diffuse Fernmetastasierung immer gegeben. Dies schließt auch benigne, kleine NFPT ein, da diese ein signifikantes Potential zur malignen Entartung haben.
Whipple-
Die meisten Autoren empfehlen heute ein aggressives chirurgisches Verfahren, auch bei regionalen Metastasen. Das wesentliche Ziel ist die potenziell kurative Resektion ohne Zurücklassen von Tumor (R0-
Operatives Vorgehen
Kleine sporadische NFPT (< 2cm) ohne Hinweise auf Metastasierung sollten parenchymsparend enukleiert werden, sofern dies ohne Verletzung des Pankreasganges durchgeführt werden kann. Dies lässt sich auch gut laparoskopisch bewerkstelligen. Bei Patienten mit größeren NFPT im Bereich des Pankreaskopfes sollte dagegen immer eine partielle Pankreatikoduodenektomie durchgeführt werden. Hierbei ist inzwischen, wenn technisch möglich, die pyloruserhaltende Variante die Methode der Wahl, da in prospektiv, randomisierten Studien die Gleichwertigkeit der pylorus-
MEN1-
Spezielle Informationen zu den MEN1-
Laparoskopisches Vorgehen
Laparoskopische Chirurgie für kleine pNENSs ist sinnvoll, technisch machbar und sicher. Die Planung und Durchführung sollte allerdings nur in Zentren erfolgen, die eine ausgewiesene Expertise für die endokrine Pankreaschirurgie und die laparoskopische Chirurgie im Allgemeinen haben. Unsere Klinik führt bereits seit mehreren Jahren laparoskopische Operationen bei pNENSs erfolgreich durch.
Welche pNENSs eignen sich zur laparoskopischen Resektion?
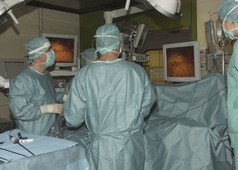 Die laparoskopische Enukleation sollte für benigne unter 2cm durchmessende Tumoren reserviert sein. Dies gilt insbesondere für Insulinome, aber auch kleine NFPT. pNENSs im Pankreaskopf können enukleiert im Pankreaskorpus oder -
Die laparoskopische Enukleation sollte für benigne unter 2cm durchmessende Tumoren reserviert sein. Dies gilt insbesondere für Insulinome, aber auch kleine NFPT. pNENSs im Pankreaskopf können enukleiert im Pankreaskorpus oder -
Laparoskopische Enukleation eines Insulinom des Pankreasschwanzes.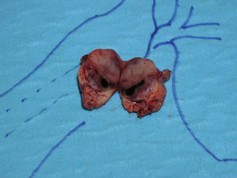 Dieser Eingriff sollte, wenn möglich, milzerhaltend durchgeführt werden. Hierzu muss das linkseitige Pankreas bis zur gedachten Resektionslinie komplett von den Milzgefäßen, ins-
Dieser Eingriff sollte, wenn möglich, milzerhaltend durchgeführt werden. Hierzu muss das linkseitige Pankreas bis zur gedachten Resektionslinie komplett von den Milzgefäßen, ins-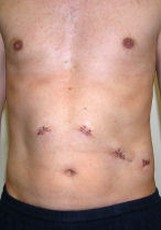
Postoperatives Ergebnis.




